فرايند خوردگي در حفاظت کاتدی
حفاظت کاتدی و مبانی الکترو شیمیایی موضوع این صفحه از مجله دانش آریا می باشد که به بررسی تخصصی آن می پردازیم. درک اصول سيستمهاي حفاظت کاتدي بر پایه درک ماهيت فرايند خوردگي است.
خوردگي فلزات یک فرايند الکتروشيميایي است. در اين فرايند، يک مدار الکتريکي وجود دارد که جابجایی الکترونها از طريق واکنشهاي شيميايي در قسمتی از آن انجام ميشود. اين واکنشهاي شيميايي در سطحي از فلز که در مجاورت الکتروليت است رخ ميدهد.
واکنشهاي اکسيداسيون (خوردگي) در سطح آند و واکنشهاي کاهشی در سطح کاتد انجام ميشوند. سيستمهاي کنترل خوردگي با تبديل سازة حفاظت شده به کاتد در يک پيل خوردگي بزرگتر، اين واکنشهاي اکسيداسيون را جابجا کرده و »سيستم حفاظت کاتدي« ناميده ميشوند.
آندها در سيستم حفاظت کاتدي براي ايفاي نقش آند در اين پيل خوردگي بزرگتر نصب میشوند و مکاني را براي انجام تمامي واکنشهاي اکسيداسيون در پيل فراهم ميآورند. براي توصيف دقیق اصول حفاظت کاتدي، لازم است که ماهيت دقيق فرايند خوردگي با جزئيات کامل شرح داده شود.
لینک های مفید : انواع خوردگی در حفاظت کاتدیک

پيل خوردگي در حفاظت کاتدی
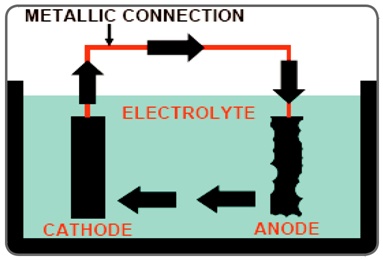
خوردگي تخريب يک ماده در اثر واکنش آن با محيط اطراف ميباشد. در یک فلز، اين تخريب اصولا طي يك فرايند الکتروشيميايي صورت ميگيرد. این فرايند طی چهار مسیر مجزاي آند، کاتد، الکتروليت و فلز رخ میدهد. اين چهار جزء »پيل خوردگي« را تشکيل ميدهند و خوردگي الکتروشيميايي فقط زماني اتفاق ميافتد. که هر چهار عامل حاضر باشند. براي درک عملکرد سيستم حفاظت کاتدي، شناخت اين چهار جزء پيل خوردگي الکتروشيميايي بسيار مهم است.
لینک های مفید : خوردگی یا فرسودگی فلزات
آنـد
واضـح تريـن بخـش پيـل خوردگـي آنـد ميباشـد. خوردگـي در ايـن قسـمت رخ ميدهـد. در يـک پيـل خوردگـي آنـد جایـی اسـت کـه در آن جريـان الکتريسـيته بـه طريـق شـيميايي از سـطح فلـز وارد الکتروليـت ميشـود. ايـن واکنـش شـيميايي يک واکنش اکسيداسـيون اسـت، که مشـخصه آن از دسـت دادن يک الکترون توسـط فلـز و ترکيـب شـدن آن با يـک عنصر ديگـر، معمولا اکسـيژن، ميباشـد. درمورد فـولاد، مـاده حاصـل اکسـيد آهـن (زنگ آهن) اسـت.
کاتد
دومين قسمت از پيل خوردگي کاتد ميباشد. کاتد جايي است که حفاظت ميشود. در يک پيل خوردگي کاتد جایی است که در آن جريان الکتريسيته به طريق شيميايي از الکتروليت به سطح فلز وارد ميشود. اين واکنش شيميايي يک واکنش کاهشي است که مشخصه آن فلز رسانای الكترونها تا الكتروليت میباشد.
رابطه آند/کاتد
يک الکترود در پيل خوردگي الکتروشيميايي با توجه به پتانسيل الکتريکي آن در مقايسه با الکترود ديگر، به آند يا کاتد تبدیل ميشود. اين اختالف پتانسيل الکتريکي كه نيروي محرکه الکتريکي پيل است، اختالف ولتاژ بين آند و کاتد ميباشد. الکترود فعالتر، يا با ولتاژ منفيتر، خورده شده و طبق تعريف آند محسوب ميشود.
الکترود نجيبتر، يا با ولتاژ مثبتتر، الکترونها را از الکترولیت عبور میدهد (واکنشهاي کاهش) و طبق تعريف کاتد محسوب شده و دچار خوردگي (واکنشهاي اکسيداسيون) نميشود. همانطور که قبلا گفته شد، در پيل خوردگي الکتروشيميايي چهار عامل مجزا وجود دارند که همه آنها بايد براي ايجاد يک مدار کامل و برقرار شدن جريان (انجام خوردگي) موجود باشند.
الکتروليت
سومين بخش پيل خوردگي الکتروليت است. الکتروليت محلي است كه در آن يونها جريان مييابند. هر مادهاي که در تماس با آند و کاتد باشد.
مسير فلزي
چهارمين بخش پيل خوردگي مسير فلزي ميباشد. مسير فلزي مدار را کامل کرده و اجازه ميدهد که الکترونها جريان پيدا كنند. هر فلزي که هم با آند و هم با کاتد در تماس بوده و جريان يافتن الکترونها را امکانپذير سازد همان مسير فلزي است. اين جريان الکتروني بايد وجود داشته باشد تا خوردگي الکتروشيميايي رخ دهد. در مورد مخزن يا خط لوله، مسير فلزي ميتواند خود مخزن يا لوله يا اتصال فلزي آن به يک سازه فلزي ديگر باشد.
مجـدداً تکـرار ميکنيـم کـه هـر چهار قسـمت پيـل خوردگي بايـد حاضر باشـند تا خوردگـي الکتروشـيميايي رخ دهـد. زمانيکـه هـر چهـار قسـمت وجود داشـته باشـند شـرايط يـك مـدار بسـته بوجـود آمـده و جريـان درون ايـن مـدار برقـرار ميشـود. خوردگـي صرفـاً در آنـد پيـل، کـه در آن واکنشهـاي اکسيداسـيون روي ميدهنـد، اتفـاق ميافتـد. يـك نمونـه آشـنا از پيـل خوردگـي، باتري پيل خشـک معمولي اسـت. در ايـن باتـری دو فلـز مختلـف کـه يکي از آنهـا آند و ديگـري کاتد ميباشـد در تماس بـا یـک الکتروليـت پيوسـته قـرار دارنـد کـه بـا فراهـم شـدن مسـیر فلـزی در مـدار، جريـان برقـرار ميشـود.
حفاظت کاتدی و مبانی الکترو شیمیایی
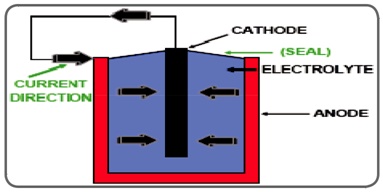
پیل خوردگی
واکنـش خوردگـي بـه صـورت چرخهـای عمـل میکنـد و در آن لازم اسـت هر چهـار عنصـر پيـل وجـود داشـته و در جهـت پيشـرفت واکنـش خوردگـي الکتروشـيميايي عمـل کننـد. حـذف هـر يـک از مؤلفههاي پيـل الکتروشـيميايي يـا جلوگيـري از رخداد واکنشهـاي مجـزاي آنـد يـا کاتـد، ميتوانـد مانـع از انجـام کل فراينـد خوردگي شـود.
حفاظت کاتدی و مبانی الکترو شیمیایی
واکنش آندي
در آند، اتمهاي فلز يک يا چند الکترون از دست داده و بصورت يونهاي فلزي درميآيند. فرمول کلي اين واکنش با استفاده ار نمادهاي شيميايي به صورت زير است:
نمـاد M0 نشـاندهنده يـک اتـم فلـز ماننـد آهـن يـا مـس در يـک قطعـه فلـزي، فلـش نشـاندهنده جهـت پيشـرفت واكنـش و نمـاد M+ مربوط بـه يون فلزي میباشـد. يونهـاي فلـزي تشـکيل شـده در واکنـش خوردگـي قطعـه فلـزي را تـرک کـرده و وارد محيـط (الکتروليـت) ميشـوند. نمـاد e- مربـوط بـه الکتـرون بـا بـار منفـي اسـت کـه بـا تشـکيل يـون فلـزي آزاد ميشـود. الکتـرون آزادي کـه در واکنـش خوردگـي ايجـاد ميشـود. در داخـل قطعـه فلـز باقـي ميمانـد. فرمـول واكنـش بـراي يـک واکنـش آندي خـاص نظيـر واکنـش خوردگـي مـس بـه صـورت زيـر بيان ميشـود.
واکنش کاتدي
واکنشهاي زيادي ممکن است در کاتد رخ دهند. سادهترين واکنش کاتدي واکنش يونهاي هيدروژن، که در محلولهاي آبي وجود دارند، با الکترونها و تشکيل گاز هيدروژن ميباشد. فرمول شيميايي اين واکنش چنين نوشته ميشود.
ايـن فرمـول نشـاندهنده واکنـش دو يـون هيـدروژن (2H+) بـا دو الکتـرون (e-) و تشـکيل دو اتـم هيـدروژن ميباشـد. کـه بعـداً ايـن دو بـا هم ترکيب شـده و يـک ملکول گاز هيـدروژن (H2) را بوجـود ميآورنـد. هماننـد واکنشهـاي آندي، تغييـري در بار کل ايـن واکنـش بوجـود نميآيـد. (+2 + -2 =0)
واکنـش معمـول ديگـر در کاتـد، واکنـش الکترونهـا بـا اکسـيژن حل شـده و تجزيه آب بـه يونهـاي هيدروکسـيل ميباشـد. فرمـول شـيميايي ايـن واکنـش چنيـن نوشـته ميشـود.
![]()
ايـن فرمـول نشـاندهنده کاهش اکسـيژن حل شـده (O2) در الکتروليتهـاي قليايي اسـت کـه در آن اکسـيژن و تجزيـه دو ملکـول آب (2H2O) منجـر به تشـكيل چهار يون هيدروکسيل ميشـود.(–4OH)
ساير واکنشهاي کاتدي
در ديگر واکنشهاي کاتدي، ممكن است يونهاي متفاوتي با الکترونها واکنش دهند، اما مشخصه مهم هر واکنش کاتدي کسب الکترونها ميباشد، که اين ويژگي اصلي يک واکنش کاهشي است. ممکن است کاهش يون فلز و رسوب فلز نيز رخ دهد. توجه داشته باشيد که خود فلز در واکنش کاتدي دخالت مستقيمي ندارد، مگر آنکه درصورت وجود يونهاي فلزي، ممكن است این یونها کاهش يافته (الکترون)هاي (خود را پس بگيرند) يا رسوب شوند.
فلز بصورت يون در نميآيد، الکتروني از دست نميدهد و نميتواند با اتم يا عنصر ديگري ترکيب شود (اکسيد شده يا زنگ بزند). علیرغم اینکه براي پيشرفت خوردگي بايد واکنش کاتدي رخ دهد، هيچگونه خوردگي در کاتد رخ نميدهد. اين واکنش کاهش معمولا حفاظت ناميده ميشود.
فلز در برابر يونيزه شدن محافظت شده و بنابراین از خوردگي نيز محافظت ميشود. اين فرايند عوامل زيادي را نيز بوجود ميآورد که سرعت خوردگي را کاهش ميدهند. از جمله کاهش يونهاي هيدروژن (که منجر به تغيير PH در جهت قليايي شدن محيط ميگردد)؛ تشکيل يونهاي هيدروکسيل (که اين نيز منجر به تغيير PH در جهت قليايي شدن محيط ميگردد)؛ تجزيه آب (که سبب افزايش مقاومت الکتروليت ميشود)؛ و تشکيل يک لایه هيدروژن بر روي کاتد (که سبب افزايش مقاومت کاتد تا الکتروليت میشود).
الکترونهـاي آزاد شـده در آنـد در درون مسـير فلـزي جريـان يافتـه و در کاتـد مجـدداً ترکيـب ميشـوند. الکتروليـت يونهـاي لازم بـراي واکنـش کاتـدي را فراهـم آورده و يونهـاي فلـزي تشـکيل شـده در آنـد را در خـود حـل ميکنـد.
متداولترين الکتروليـت آب يـا محلـول آبـی ميباشـد. ايـن آب ميتوانـد آب شـهری، آب دريـا، آب جمـع شـده در منافـذ خـاک يـا آب نظيـر بارندگـي يـا شـبنم باشـد. ذکـر ايـن نکتـه مهـم اسـت کـه جريـان حفاظـت کاتـدي و خوردگـي بحث شـده در ايـن کتاب نشـريه بيـن المللـي NACE، جریـان قـراردادي اسـت و با شـارش جريـان مثبت در نظـر گرفتـه ميشـود.
سـريهای گالوانيکـی
دو فاکتـور اصلـي تأثيرگـذار بـر سـرعت خوردگي در يـک پيـل خوردگي الکتروشـيميايي، مشـخصات الکتريکـي الکتروليت (مقاومـت ويژه) و اختـلاف ولتـاژ بيـن آنـد و کاتـد هسـتند. مقاومت ويـژه الکتروليـت معمولا قابـل کنترل نيسـت امـا ميتـوان آنرا اندازهگیـری کـرد. ولتاژ يا پتانسـيل آنـد و کاتد فلـزي نيز قابل اندازهگيـري ميباشـد. ولتـاژ اندازهگيـري شـده همـان اختـلاف ولتـاژ بيـن دو الکتـرود اسـت.
از آنجـا کـه ايـن پتانسـیل فقط بـه يک اختلاف ولتاژ وابسـته اسـت، بايـد مرجعي وجـود داشـته باشـد کـه تمامـي الکترودهـاي ديگـر را بتـوان نسـبت بـه آن اندازهگيري کـرد تـا يـک جـدول يـا سـري نسـبي از پتانسـيل الکترودهـاي مشـخصي تهيـه شـود. همانطورکـه قبـلاً ذکـر شـد، فلـزات پتانسـيلهای متفاوتي دارنـد و همچنین هـر فلز در الکتروليتهـاي متفـاوت پتانسـيلهاي مختلفـي دارد.
بـراي ایـن کـه الکترودي بـه عنوان مبنـاي اندازهگيـري سـاير الکترودها بـه کار رود، بايـد فلـز و الکتروليت در تماس با آن مشـخص شـوند. بـا انجام ايـن کار، الکترود بصورت الکتـرود مبنـا درميآيد.
تاکنـون انـواع بسـياري از الکترودهـاي مبنـا مورد اسـتفاده قـرار گرفته اسـت. در آزمايشـگاه، اسـتفاده از نـوع هيـدروژن/ هيـدروژن (الکتـرود هيـدروژن، الکتروليـت هيـدروژن) متـداول اسـت. در کاربـرد میدانـی، مس/سـولفات مـس (الکتـرود مـس، الکتروليـت سـولفات مـس کامـلاً اشـباع) بـه کار مـیرود. مگـر در آب شـور کـه از نقـره / کلريـد نقـره (الکتـرود نقـره، الکتروليـت کلريـد نقـره) اسـتفاده ميشـود و بايـد بـا فاکتـور الکتروليـت يا ميـزان کلريـد موجـود در الکتروليـت تنظيم شـود.
اين الکترودهـاي مبنـا صرفـاً الکترودهـاي پايـدار بـا پتانسـيل مشـخصي ميباشـند کـه بـراي اندازهگيـري پتانسـيل الکترودهـاي نامشـخص بـکار ميرونـد. بـا اسـتفاده از الکترودهـاي مبنـا ميتـوان مقـدار پتانسـيل هـر فلـز در هـر الکتروليـت را ثبـت کرد و آنرا بـا دیگـر الکترودهـا مقايسـه نمـود.
جدولـي کـه از چنيـن مقادیـری تشـکيل شـده اسـت را سـري گالوانيکـي اندازهگيريهـا مينامنـد. در هـر جدول بايـد الکترود مبنـاي مـورد اسـتفاده در اندازهگيـري و الکتروليـت حـاوی الکترودهـاي نامشـخص، مشـخص گـردد تـا کارشناسـان خوردگـي بتواننـد آن را تفسـير کنند. سـپس ميتوان از ايـن سـري بـراي تعييـن الکتـرود آنـد (که خـورده میشـود) در يک پيـل خوردگي الکتروشـيميايي اسـتفاده کـرد.




دیدگاه خود را بنویسید